Az Európai Uniónak az a bizottsága, ami többek között az újonnan megjelenő gyógyszerek véleményezésével foglalkozik, pozitívan értékelte az ozanimod nevű hatóanyagot. Ez egy amerikai gyártású készítmény, és ott március óta már engedélyezett a használata (igaz, a koronavírus-járvány miatt a széles körű terjesztése késik egy kicsit).
A gyógyszer olyan relapszáló-remittáló sclerosis multiplex betegek számára javallott, akiknek shubjai látható vagy érezhető tünetek formájában és az MRI felvételeken is megjelennek. Adagolása kapszula formájában történik, amit naponta egyszer bevenni.
Az ozanimod úgy működik, hogy visszatartja a fehérvérsejtek kiáramlását a nyirokszövetekből. Azt, hogy ez SM‑ben pontosan hogyan válik a betegek előnyére, még nem teljesen világos, de valószínűleg csökkenti a fehérvérsejtek bejutását a központi idegrendszerbe, így azok nem tudják megtámadni az agyat és a gerincvelőt.
A készítmény hatásosságát egy olyan kutatás igazolta, amiben béta-interferonnal vetették össze a működését. 1346 beteg adatai alapján az éves relapszus-ráta az első évben 0,18, a második évben 0,17 volt, szemben a béta-interferon 0,35 illetve 0,28-as eredményével.
A gyógyszer leggyakoribb mellékhatása a fertőzésekkel szembeni fokozott érzékenység, ami érthető is, hiszen a gyógyszer működési elve az, hogy nem engedi ki a szervezetbe azokat a sejteket, amelyek a kórokozók ellen felléphetnének. A gyógyszer szedése nem javasolt néhány súlyosabb szívbetegség esetén, és alkalmazását megelőzően teljes vérkép vizsgálat szükséges.
A bizottság pozitív ajánlása után az Európai Unió június 1-ig dönt a forgalomba hozatali engedélyről. Amennyiben ez megvalósul, az egyes országok maguk döntenek majd a gyógyszer áráról és állami támogatásáról.
Bővebben:
Új készítmény az RRSM-ben szenvedők részére → OTSZ Online
Ozanimod → MS Trust

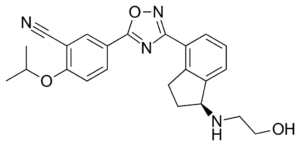

 A Szegedi Tudományegyetem professzorai több mint tíz éves kutatómunkával egy olyan technológiát fejlesztettek ki, amivel minden eddiginél hatékonyabbá válhat az
A Szegedi Tudományegyetem professzorai több mint tíz éves kutatómunkával egy olyan technológiát fejlesztettek ki, amivel minden eddiginél hatékonyabbá válhat az 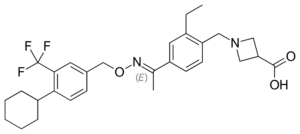
 Az Európai Bizottság rendszerint 2-3 hónappal a hivatalos ajánlást követően dönt a forgalomba hozatal engedélyezéséről. A forgalmazási engedély kiadása után a gyógyszer árazásáról az EU tagállamai már külön-külön állapodnak meg, figyelembe véve a gyógyszer potenciális szerepét az adott ország egészségügyi rendszerén belül.
Az Európai Bizottság rendszerint 2-3 hónappal a hivatalos ajánlást követően dönt a forgalomba hozatal engedélyezéséről. A forgalmazási engedély kiadása után a gyógyszer árazásáról az EU tagállamai már külön-külön állapodnak meg, figyelembe véve a gyógyszer potenciális szerepét az adott ország egészségügyi rendszerén belül.
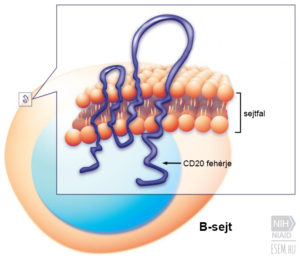
 Az FDA tegnapi engedélyezése csak az Egyesült Államokban történő használatra érvényes. Noha ott már két héten belül az orvosi protokoll részévé válik a gyógyszer használata, az európai piac kapui még zárva vannak az ocrelizumab előtt. Az engedélyezési kérelem már be lett adva az EMA felé is, akik minden valószínűség szerint az FDA-hoz hasonló pozitív ítéletet fognak hozni, így remélhetőleg hamarosan az Európai Unió országaiban élő betegek számára is elérhetővé válik ez az új terápiás lehetőség.
Az FDA tegnapi engedélyezése csak az Egyesült Államokban történő használatra érvényes. Noha ott már két héten belül az orvosi protokoll részévé válik a gyógyszer használata, az európai piac kapui még zárva vannak az ocrelizumab előtt. Az engedélyezési kérelem már be lett adva az EMA felé is, akik minden valószínűség szerint az FDA-hoz hasonló pozitív ítéletet fognak hozni, így remélhetőleg hamarosan az Európai Unió országaiban élő betegek számára is elérhetővé válik ez az új terápiás lehetőség.