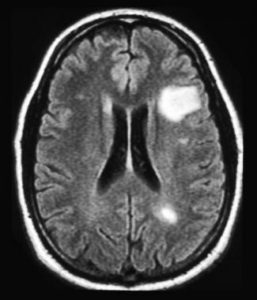
Kvantumpontok, vagy más néven nano-méretű (a milliméter egymilliomod része) részecskék segítségével sikerült átprogramozni az egerek immunrendszerét úgy, hogy az ne támadja meg a myelinhüvelyt. Ennek azért van jelentősége a sclerosis multiplex páciensek számára, mert az ő betegségük lényege, hogy az immunrendszer megtámadja és pusztulásra ítéli az idegeket körülvevő myelinburkot.
 Az antigének azok az anyagok, melyeket az immunrendszer felismer, és immunválasszal reagál rájuk. A kutatók myelin-antigéneket helyeztek el rendkívül apró részecskéken, amiket azután egerekbe juttattak. Próbálkoztak sok antigént tartalmazó kevés kvantumpont, valamint kevés antigént tartalmazó sok kvantumpont bejuttatásával is. Mint kiderült, ez utóbbi alkalmas arra, hogy az egerek immunrendszere toleranciát fejlesszen ki a myelin-antigénekkel szemben. Az így átprogramozott immunrendszer a továbbiakban az egér agyában lévő myelint már nem támadja meg.
Az antigének azok az anyagok, melyeket az immunrendszer felismer, és immunválasszal reagál rájuk. A kutatók myelin-antigéneket helyeztek el rendkívül apró részecskéken, amiket azután egerekbe juttattak. Próbálkoztak sok antigént tartalmazó kevés kvantumpont, valamint kevés antigént tartalmazó sok kvantumpont bejuttatásával is. Mint kiderült, ez utóbbi alkalmas arra, hogy az egerek immunrendszere toleranciát fejlesszen ki a myelin-antigénekkel szemben. Az így átprogramozott immunrendszer a továbbiakban az egér agyában lévő myelint már nem támadja meg.
A már meglévő gyógyszerekhez képest ez a kezelés azért lenne sokkal hasznosabb, mert az immunrendszer elnyomása helyett annak átprogramozásával dolgozik, így várhatóan nem növeli más megbetegedések kockázatát, és jóval kevesebb mellékhatással jár majd az alkalmazása.
Bővebben: Engineering Immunological Tolerance Using Quantum Dots to Tune the Density of Self-Antigen Display


 Az
Az  A sclerosis multiplex betegek gyakori tünete az egyensúlyzavar, amit a kisagyban megjelenő demyelinizáció okoz. A kisagy (cerebellum) hátul, a tarkó magasságában, a nagyagy alatt helyezkedik el. Egyik fő funkciója a mozgáskoordináció, ennélfogva sérülése esetén a mozgás összerendezésének zavarát, egyensúlyvesztést és a
A sclerosis multiplex betegek gyakori tünete az egyensúlyzavar, amit a kisagyban megjelenő demyelinizáció okoz. A kisagy (cerebellum) hátul, a tarkó magasságában, a nagyagy alatt helyezkedik el. Egyik fő funkciója a mozgáskoordináció, ennélfogva sérülése esetén a mozgás összerendezésének zavarát, egyensúlyvesztést és a