A Magyar Neuroradiológiai Társaság XXV. kongresszusán Rózsa Csilla arról tartott egy vitaindítónak szánt előadást, hogy a sclerosis multiplex aktivitásának követéséhez igenis fontos a rendszeres MRI vizsgálat.
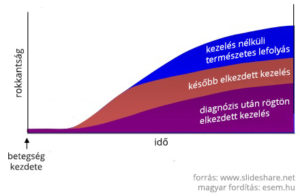
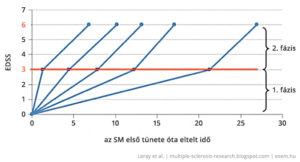
A jelenlegi betegségmódosító terápiák mindegyike az idegrendszeren belüli gyulladások csökkentésére fókuszál. Ez azonban az SM-nek csak az egyik megnyilvánulása. A hosszabb távú, maradandó állapotromlásért az agysorvadás is nagy mértékben felelős, aminek megelőzésére nincsenek meg a módszereink. Mivel a gyulladásokkal járó demyelinizációs fázis a betegség elejére jellemző, ezért az SM kezelésének idői ablaka igen szűkös. Minél előbb belekezd a beteg valamelyik gyógykezelésbe, annál későbbre tudja kitolni a második, progresszív fázis jelentkezését.
Nagy általánosságban elmondható, hogy minél hatékonyabb egy terápia, annál több mellékhatással jár, és annál több monitorozás szükséges az alkalmazása folyamán. Mivel nincs semmiféle iránytű, ami megmondja, melyik páciens számára melyik gyógyszer a leghatékonyabb és a legkíméletesebb, ezért az enyhébb esetekben a terápia beindítása próbálgatás útján kezdődik. Agresszívebben induló SM esetén a helyzet majdnem ugyanez, annyi különbséggel, hogy a fent leírt tesztidőszakot egy intenzív immunrendszer-elnyomás előzi meg, és csak akkor következik a próba-szerencse módszer, miután a beteg állapota normalizálódott.
Mivel a terápia megindítása nagy kockázatvállalás és emiatt egy komoly elhatározás a beteg részéről, sokakban felmerül az óhaj, bárcsak meg lehetne jósolni a betegségük lefolyását. Az utóbbi években sok vizsgálat irányult arra, hogy a relapszusok száma és az MRI képek rövid távú változásai alapján előrevetítsék a hosszú távú kórlefolyást. Az alábbi két értékelő rendszer arra hivatott, hogy ilyen megközelítő jóslatokkal nyújtsanak segítséget a terápiás döntések meghozatalában.
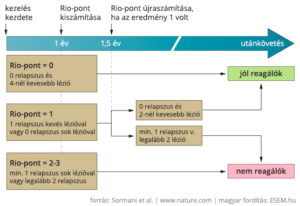
A Rio-pont (Rio Score, RS) egyszerűsített változata, a módosított Rio-pont (Modified Rio Score, MRS) a relapszusok és a T2 léziók számából vetíti előre azt, hogy valaki jól fog-e reagálni a kezelésre a későbbiekben vagy sem. A terápia kezdete után egy évvel felvett adatok alapján elég nagy biztonsággal megjósolható a terápia hosszabb távon hatékony vagy sikertelen kimenetele. A magasabb, 2-3-as pontszám itt arra utal, hogy a betegnek a kezelés második évétől nagy esélye van a progresszióra, ha nem vált gyógyszert.
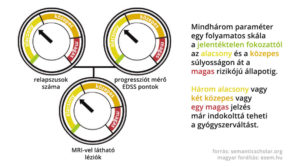
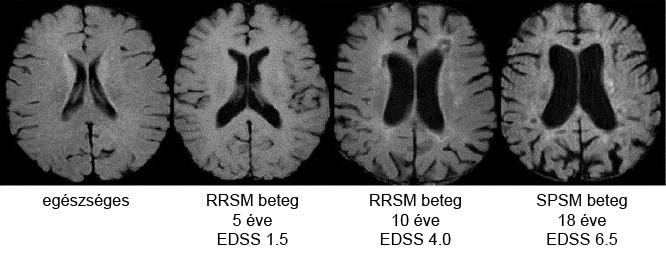
A kanadai kezelésoptimalizálási modell (Canadian Treatment Optimization Model) a relapszusok száma és az MRI leletek mellett a progresszió mértékét is belekalkulálja a jóslatba. A gyógykezelés megindítása után egy évvel számba kell venni (1) az azóta megjelenő relapszusok számát, súlyosságát és gyógyulását, (2) a progresszió fokának meghatározásához az EDSS pontok alakulását és az érintett területeket (azaz hogy szenzoros, motoros, kisagyi vagy kognitív funkciókat érintett-e az állapotromlás), valamint (3) az MRI képek alapján a léziók számát. A fenti három paraméter mindegyikét értékelni kell súlyosságuk szerint. Ha az jön ki, hogy a páciens jól reagál a gyógyszerre, akkor érdemes folytatni a kezelést, ha azonban legalább egy magas, vagy két közepes, vagy mindhárom területen alacsony súlyosságú a beteg állapota, akkor érdemes átállnia egy másik gyógyszerre.
A fenti modellek használatához nélkülözhetetlen a rendszeresen végzett, szakszerűen kivitelezett MRI vizsgálat, annak egészségügyi hatásával és financiális vonzatával együtt. Az ellentétes véleményen lévők azonban azt vallják, hogy a klinikai kép számít, így MR-re ritkán, inkább csak kiegészítő vizsgálatként van szükség.
 Magyarországon jelenleg összesen 79 MRI berendezés érhető el. Ebből mindössze 14 gép 3 Tesla erősségű, és ezek közül 2 készülék vehető igénybe a magánszektorban: ebből az egyik a budapesti Budai Egészségközpontban, a másik pedig Zalaegerszegen az Integrity Magánklinikán található. (A Tesla az MRI berendezés által keltett mágneses tér erősségének mértékegysége.)
Magyarországon jelenleg összesen 79 MRI berendezés érhető el. Ebből mindössze 14 gép 3 Tesla erősségű, és ezek közül 2 készülék vehető igénybe a magánszektorban: ebből az egyik a budapesti Budai Egészségközpontban, a másik pedig Zalaegerszegen az Integrity Magánklinikán található. (A Tesla az MRI berendezés által keltett mágneses tér erősségének mértékegysége.)
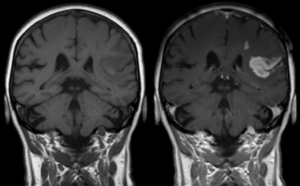
 Az MRI a test mágneses tulajdonságait felhasználva ad képet a központi idegrendszerről. Az MRI berendezés által keltett mágneses tér erősségének mértékegysége a Tesla (T). A napjainkban hazánkban üzemelő MRI berendezések jellemzően 1,5 T erősséggel működnek, ami körülbelül 30 000-szerese a Föld mágneses mezőjének, illetve 75-szöröse egy erős hűtőmágnesnek.
Az MRI a test mágneses tulajdonságait felhasználva ad képet a központi idegrendszerről. Az MRI berendezés által keltett mágneses tér erősségének mértékegysége a Tesla (T). A napjainkban hazánkban üzemelő MRI berendezések jellemzően 1,5 T erősséggel működnek, ami körülbelül 30 000-szerese a Föld mágneses mezőjének, illetve 75-szöröse egy erős hűtőmágnesnek.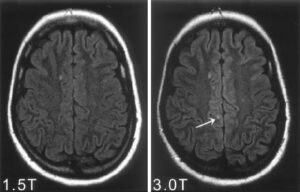
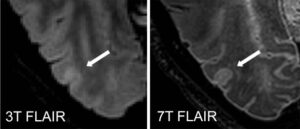
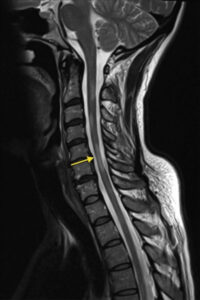
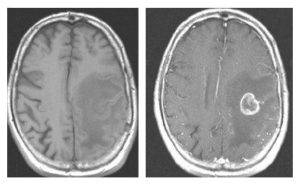



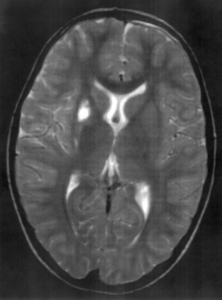
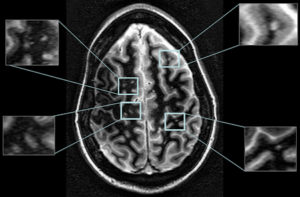 Bár a legmodernebb MRI gépek Magyarországon még nem állnak az orvosok rendelkezésére, a legtöbb esetben az itthon elérhető készülékek is elegendőek a diagnózis felállításához és az SM követéséhez.
Bár a legmodernebb MRI gépek Magyarországon még nem állnak az orvosok rendelkezésére, a legtöbb esetben az itthon elérhető készülékek is elegendőek a diagnózis felállításához és az SM követéséhez.