A sclerosis multiplex és a sportolás kapcsolatát viszonylag gyakran kutatják. Több vizsgálat áttekintése alapján például úgy tűnik, hogy a rendszeres sportolás 27%-kal csökkenti az újabb relapszusok megjelenésének esélyét [1]. Arról azonban sajnos jóval kevesebb információt lehet találni, hogy relapszus idején milyen hatása van a mozgásnak, pedig a betegek számára ez kifejezetten hasznos információ lenne.
A sclerosis multiplex és a sportolás kapcsolatát viszonylag gyakran kutatják. Több vizsgálat áttekintése alapján például úgy tűnik, hogy a rendszeres sportolás 27%-kal csökkenti az újabb relapszusok megjelenésének esélyét [1]. Arról azonban sajnos jóval kevesebb információt lehet találni, hogy relapszus idején milyen hatása van a mozgásnak, pedig a betegek számára ez kifejezetten hasznos információ lenne.
Címke: relapszus
A depresszió hatása a sclerosis multiplexre
Egy 2505 relapszáló-remittáló sclerosis multiplex beteg bevonásával készült, egy éven át tartó megfigyelés során kiderült, hogy a depresszió rossz hatással van a kognitív teljesítményre, és növeli az aktív agyi léziók számát.
A depressziós betegeknek már a vizsgálat kezdetén is lassabb volt az információfeldolgozási és a járási sebességük, továbbá több volt az aktív agyi léziójuk.
Egy év elteltével az információfeldolgozási sebességük továbbra is rosszabb volt, mint a kiegyensúlyozott kedélyállapotú betegeknek, sőt nem számottevő mértékben a járásuk és a kézügyességük is romlott, de a saját állapotukról szóló beszámolók szerint ők ezeket nem érzékelték. Az újabb MRI leletek szerint az aktív léziók száma továbbra is magasabb volt, ezen felül pedig a szürkeállomány és az egész agy térfogatának csökkenése fokozottabb volt a depressziósok esetében.

A kutatók szerint mindez arra utal, hogy az SM betegek depressziója nem feltétlenül valamilyen külső körülményre adott érzelmi válasz, hanem az SM fellángolásának közeljövőben várható fokozott kockázatát jelzi. Éppen ezért érdemes lenne rutinszerűen felmérni az időről időre orvosukhoz látogató betegek lelki állapotát, és amennyiben kiderül, hogy valaki depresszióban szenved, azt kezelni, hiszen a kedélyállapot kimutathatóan hatással van az SM lefolyására.
A vizsgálat részéleteiről bővebben:
Sclerosis multiplex és neurális diszfunkció → OTSZ Online
A stressz hatása sclerosis multiplexre
Manapság már közhelyszámba megy, hogy a stressz rossz hatással van az egészségre, krónikus betegként azonban érdemes külön azt is mérlegelni, hogy a már meglévő egészségügyi problémákat hogyan befolyásolhatja a stressz.
Egy 14 kutatás adatait elemző metaanalízis épp ezt tette sclerosis multiplex betegetek körében, és azt találta, hogy a stressz nagyságrendileg 53%-kal növeli a relapszusok megjelenésének esélyét (a pontos értékről azt lehet tudni, hogy az 95%-os valószínűséggel esik a 40-65%-os tartományba). Hogy szélesebb perspektívába helyezzük ezt az 53%-ot, érdemes összehasonlítani az SM betegek számára elérhető betegségmódosító terápiákkal: az interferon-béta körülbelül 30%-kal csökkenti a relapszusok számát, és bár több hatékonyabb gyógyszer is forgalomban van már, azok is hasonló nagyságrendbe esnek. Az ocrelizumab például 46-47%-kal hatékonyabb az interferon-bétánál, tehát az kb. 44%-kal képes mérsékelni a relapszus-rátát.
 A fenti összehasonlítás célja természetesen nem a gyógyszeres kezelések megkérdőjelezése, hiszen azok a stressz mértékének csökkentésétől teljesen eltérő hatásmechanizmuson alapszanak. Az összevetés inkább abból a szempontból érdekes, hogy a stressz legalább olyan vagy még nagyobb hatást gyakorolhat a relapszusok megjelenésére, mint az amúgy minden beteg számára ajánlott gyógyszeres kezelések. Ez különösen fontossá teheti a stresszkezelést az SM betegek körében.
A fenti összehasonlítás célja természetesen nem a gyógyszeres kezelések megkérdőjelezése, hiszen azok a stressz mértékének csökkentésétől teljesen eltérő hatásmechanizmuson alapszanak. Az összevetés inkább abból a szempontból érdekes, hogy a stressz legalább olyan vagy még nagyobb hatást gyakorolhat a relapszusok megjelenésére, mint az amúgy minden beteg számára ajánlott gyógyszeres kezelések. Ez különösen fontossá teheti a stresszkezelést az SM betegek körében.
Az ok-okozati kérdés sajnos továbbra is tisztázatlan, hiszen a kutatás jellege miatt nem lehet teljes mértékben igazolni, hogy valóban maga a stressz váltja ki a relapszusokat, és nem például egy független harmadik változó a stresszt és a relapszusokat együttesen. Azt viszont bátran elmondhatjuk, hogy a stressz mérséklésének nem valószínű, hogy bármilyen negatív hatása lenne, így még ha ok-okozati összefüggés nem is áll fenn a kettő között, veszíteni senki sem tud vele.
Bővebben: Association between stressful life events and exacerbation in multiple sclerosis: a meta-analysis
Relapszusok számának csökkenése SPSM-ben
A másodlagos progresszív sclerosis multiplex betegeknél is előfordulnak relapszusok, azonban ezek száma a relapszáló-remittáló betegekhez képest alacsonyabb. Egy nemrégiben végzett, 506 fő bevonásával készült kutatás pontosabb adatokkal is szolgált a relapszusok jelentkezéséről.
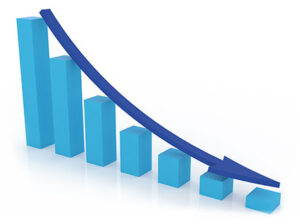 Az eredmények szerint a relapszusok száma a korral és a betegség előrehaladtával együtt csökken: a 30-40 éves SPSM betegek éves átlaga 0,11 relapszus, a 40-50 éveseké 0,06, az 50-60 éveseké 0,04 és a 60 évnél idősebbeké 0,01. A kutatók megfigyelése szerint az SPSM kórformára váltás első öt évében megjelenő relapszusok még érdemi hatással lehetnek a beteg életére, az öt év után jelentkező shubok viszont már nemigen súlyosbítják a páciens állapotát. Ezeket az adatokat érdemes lehet figyelembe venni a betegségmódosító gyógyszerek megválasztása során.
Az eredmények szerint a relapszusok száma a korral és a betegség előrehaladtával együtt csökken: a 30-40 éves SPSM betegek éves átlaga 0,11 relapszus, a 40-50 éveseké 0,06, az 50-60 éveseké 0,04 és a 60 évnél idősebbeké 0,01. A kutatók megfigyelése szerint az SPSM kórformára váltás első öt évében megjelenő relapszusok még érdemi hatással lehetnek a beteg életére, az öt év után jelentkező shubok viszont már nemigen súlyosbítják a páciens állapotát. Ezeket az adatokat érdemes lehet figyelembe venni a betegségmódosító gyógyszerek megválasztása során.
Bővebben: Relapses in patients with secondary progressive MS: a matter of disease duration or age?
A relapszusok számának csökkenése életkorfüggő
 A sclerosis multiplex az esetek körülbelül 85%-ában relapszáló-remittáló formában jelentkezik, és a korai felnőttkorban, azaz jellemzően 20 és 40 éves kor között kezdődik. A kor előrehaladtával azonban a relapszusok és a léziók száma folyamatosan csökken. A megfigyelések szerint például az 55 és 60 év közötti betegek körében különösen alacsony egy-egy új relapszus megjelenésének esélye.
A sclerosis multiplex az esetek körülbelül 85%-ában relapszáló-remittáló formában jelentkezik, és a korai felnőttkorban, azaz jellemzően 20 és 40 éves kor között kezdődik. A kor előrehaladtával azonban a relapszusok és a léziók száma folyamatosan csökken. A megfigyelések szerint például az 55 és 60 év közötti betegek körében különösen alacsony egy-egy új relapszus megjelenésének esélye.
A relapszusok és a léziók életkorfüggő csökkenésének számszerűsítése azért is fontos kérdés, mert a legszélesebb körben használt betegségmódosító terápiák szintén a relapszusok és a léziók megjelenését szorítják vissza. (Épp ezért van az, hogy ezek a gyógyszerek csak a relapszáló-remittáló SM esetében javallottak, és 40 éves kor alatt a leghatékonyabbak.) Hosszú távon tehát az öregedéssel együtt járó és a gyógyszernek köszönhető állapotjavulás összeadódik, összemosódik, és így nehéz eldönteni, meddig érdemes folytatni a terápiát, mikor tanácsos inkább abbahagyni a kezelést.
Egy több mint 2000 főt nyilvántartó adatbázison végzett szimulációs modell kimutatta, hogy átlagosan 22‑37%‑kal csökken a relapszusok száma ötévente, ami azt jelenti, hogy évről évre körülbelül 6%-kal kisebb az esély egy új relapszus megjelenésére. Az éves relapszus-ráta csökkenéséért 88‑97%‑ban az életkor felel, függetlenül a beteg állapotának súlyosságától. A fennmaradó 3‑12%‑ot a rokkantság okozza, mégpedig úgy, hogy a legsúlyosabb állapotban lévőknek (EDSS 8.0 felett) nagyságrendekkel rohamosabban csökken a relapszus-rátájuk a jobb állapotú (EDSS 5.5 alatti) betegekhez képest.
A relapszusok számának folyamatos csökkenése tehát elsősorban az életkortól, és nem a rokkantságtól függ. Ez az információ nem csak azoknak az idősebb betegeknek lehet hasznos, akik a már megkezdett terápiájuk folytatásán vagy megszakításán gondolkodnak, hanem azoknak a fiatalabb pácienseknek is segíthet a tájékozott döntéshozatalban, akikben csak 40 éves koruk környékén merül fel a gyógyszeres kezelés lehetősége.
Bővebben:
Age-related decreases in relapses among adults with relapsing-onset multiple sclerosis
Mi a sclerosis multiplex?
olvasási idő: 10 perc
nehézségi szint: közepes
Definíció
A sclerosis multiplex (SM) a központi idegrendszer krónikus betegsége, melynek neurológiai tüneteit az axont szigetelő myelinhüvely gyulladásos károsodása (demyelinizáció), valamint magának az axonnak, illetve az idegsejtnek a pusztulása okozza. A betegség BNO kódja G35H0, ahol a „G” az idegrendszeri érintettségre utal, azon belül pedig a központi idegrendszer demyelinizációs betegségei közé tartozik („35”), további alkategóriák nélkül („H0”).
Az influenzajárvány kifejezetten erős relapszusokhoz vezethet
Korábban már mi is írtunk róla, hogy a felső légúti megbetegedések relapszust okozhatnak.
 Egy nemrég megjelent új cikk [1] a fertőzések és a sclerosis multiplex kapcsolatát feszegette, és áttekintette a témával kapcsolatos korábbi kutatásokat is. Ez alapján szemezgetünk mi is néhány olyan információt, ami most, az influenzajárvány idején érdekes lehet.
Egy nemrég megjelent új cikk [1] a fertőzések és a sclerosis multiplex kapcsolatát feszegette, és áttekintette a témával kapcsolatos korábbi kutatásokat is. Ez alapján szemezgetünk mi is néhány olyan információt, ami most, az influenzajárvány idején érdekes lehet.
Egy kutatás arra a következtetésre jutott, hogy a korai relapszáló-remittáló betegek relapszusainak többségéért kifejezetten a különböző vírusfertőzések lehetnek felelősek [2]. A betegség aktiválódását több különböző, például gyomor- vagy húgyúti fertőzés is kiválthatja, a legtöbb relapszus azonban vírusos felső légúti megbetegedésekhez kapcsolódik. Az ilyen fertőzések a relapszusok esélyét nagyságrendileg 1,5-3,5-szörösére növelik.
Hiába csak gyengék vagy közepesen erősek a fertőzés tünetei (pl. orrfolyás, köhögés, láz), a vele kapcsolatba hozható relapszusok nagyságrendileg négyszer nagyobb eséllyel vezetnek tartós neurológiai károsodáshoz, mint a spontán megjelenő shubok [3] [4] (bár ezzel nem minden kutatás ért egyet [2]). A kritikus időszak a fertőzés tüneteinek megjelenése előtti 2 héttől az azt követő 5 hétig tart.
Bár a kutatások szerint az influenza elleni védőoltás biztonságos, az oltást kapott és az abban nem részesült betegek relapszus-számai között nem találtak különbséget [5] [6].
Bár tudjuk, hogy a jelenlegi influenzajárvány megbetegedéseinek többségéért az Influenza A vírus felelős [7], és a kutatásokban ezt a vírusfajt is vizsgálták, a kutatások következtetéseit azonban általában a vizsgált vírusokra együttesen, összegezve vonták le, így sajnos nem találtunk arra vonatkozó információt, hogy konkrétan ez a most terjedő vírusfaj milyen hatással van az SM-re.
Ha szeretnél tippeket olvasni azzal kapcsolatban, hogyan kerüld el a vírusos és bakteriális fertőzéseket, olvasd el korábbi cikkünk utolsó részét!
A felső légúti megbetegedések relapszust okozhatnak
A felső légúti megbetegedések és a sclerosis multiplex betegek állapotromlásának kapcsolatával több kutatás is foglalkozott már. A Future Microbiology című lapban megjelent új cikk e vizsgálatok áttekintésére vállalkozott.
A fertőzés hatása

Több kutatás is azt találta, hogy mind a náthás tünetek előtt, mind utána megnövekszik a relapszusok száma. Ez arra utal, hogy a fertőzés állapotromláshoz vezethet, illetve maga az állapotromlás egyúttal megnövelheti a fertőzések kockázatát.
A különböző kutatások szerint a relapszusok háromszoros-négyszeres eséllyel jelennek meg a fertőzések előtt vagy után, és ezek az adatok az MRI-vel mérhető új léziók megjelenésével is korrelálnak.
Egy kutatás szerint az így talált állapotrosszabbodások 78%-a pikornavírusokhoz kapcsolódik, bár egy másik kutatás ezt nem tudta alátámasztani. Ezek a vírusok okozzák a meghűlések legnagyobb részét. Az influenza-A vírust is összekapcsolták már a relapszusok fokozott megjelenésével.
Hatásmechanizmus
Egereken végzett vizsgálatok arra utalnak, hogy a relapszust okozó T-sejtek az idegrendszerbe történő bejutás előtt a tüdőt is megjárják. A tüdőből vett T-sejtek egy másik, egészséges állat szervezetébe juttatva a tüdőbe történő bejutás nélkül is lerövidítik az EAE megjelenéséig eltelt időt. Mindezek alapján úgy tűnik, hogy a tüdő fertőzése vagy gyulladása növeli az autoimmun folyamatokért felelős T-sejtek számát, és fokozza azok bejutását a központi idegrendszerbe. A vizsgálatok szerint az egerek állapotromlását a korábbi, az EAE megjelenése előtt két hónappal átélt fertőzések is súlyosbították.
A helyzet azonban nem ilyen egyoldalú. Egyes baktériumok, mint például a Chlamydia pneumoniae és a Staphylococcus aureus növelik a relapszusok kockázatát. A tüdő gyulladása azonban nem elég a relapszusok megjelenésének elősegítéséhez: a Bordetella pertussis nevű baktérium például éppen javítja egyes egerek állapotát.
Tovább komplikálja a képletet, hogy egy kutatás szerint abban az időszakban, amikor a leggyakoribbak a felső légúti megbetegedések, a relapszusok száma történetesen alacsonyabb az átlagosnál. A szerzők ezt a jelenséget egy fertőzésektől független tényezőnek, a melatonin-termelésnek tulajdonítják, amiről szintén tudvalevő, hogy hatással van az SM progressziójára.
Javaslat

Mivel a kutatások szerint a felső légúti megbetegedések az SM fellángolásához vezethetnek, ezért minden páciensnek ajánlott megelőző lépéseket tennie a fertőzések ellen. Érdemes minél inkább elkerülni a beteg embereket. Célszerű a gyakori kézmosás (főleg hazaérkezés után és étkezés előtt). Tanácsos az arc kézzel történő érintésének kerülése. Amennyiben olyan környezetbe mész, ahol potenciálisan fertőző személyek fordulnak meg (pl. orvosi rendelő, tömegközlekedési jármű stb.), gyógyszertárban kapható orvosi maszkkal is védekezhetsz a fertőzésekkel szemben.
Bővebben:
Does upper respiratory infection exacerbate symptoms of multiple sclerosis?
A zsíros étrend jelentősen növelheti a relapszusok esélyét
A sclerosis multiplex beteg gyerekeknek a felnőttekhez képest gyakoribbak a relapszusaik, ezért ők különösen alkalmasak arra, hogy a különböző étrendek hatását tanulmányozzák rajtuk. Egy új kutatásban 219 fiatalt vizsgáltak meg, hogy pontosabb képet kapjanak az étrend SM-ben betöltött szerepéről.

A kutatás arra jutott, hogy minden 10%-nyi zsírbevitel-növekedés 56%-kal növeli a relapszusok kockázatát. Amikor a kutatók csak a telített zsírokat vették figyelembe, a növekedés 237%-ra ugrott fel. Ezzel szemben minden, nagyjából 180 grammnyi zöldség fogyasztása 50%-kal csökkentette a relapszusok esélyét.
A kutatók azt is megvizsgálták, hogy más összetevők, például a cukor, a vas, a gyümölcsök vagy a rostok befolyásolják-e a relapszusok megjelenését, ezek esetében azonban nem sikerült semmilyen összefüggést kimutatniuk.
Noha a vizsgálat megfigyelő jellege − a szisztematikus kísérletekkel ellentétben − nem alkalmas arra, hogy ez alapján kimondják, a zsír okozza a relapszusokat, ugyanakkor több olyan út is van, amin keresztül a zsírnak valóban lehet ilyen hatása.
Az itt kapott eredmények összhangban vannak Dr. Roy Swank korábbi, telített zsírokkal kapcsolatos kutatásaival és az OMS diéta által ajánlott étrenddel.
Bővebben:
Contribution of dietary intake to relapse rate in early paediatric multiple sclerosis
D-vitamint leginkább télen és kora tavasszal érdemes szedni
Az alacsony D-vitamin-szint a sclerosis multiplex kialakulásának és progressziójának jól ismert rizikófaktora, ezért az SM betegeknek különösen ajánlott a D-vitamin-szintjük mérése és szükség esetén a megfelelő értékre történő beállítása. Egy új kutatás azt vizsgálta, hogy a D-vitamin pótlása mely időszakokban fejti ki pozitív hatását.
 Mivel a D-vitamin a bőrben keletkezik az UV-B-sugárzás hatására, a kutatók nyáron mérték a legmagasabb D-vitamin szintet a betegekben. Az egyetlen időszak, amikor a vitamint nem szedő résztvevők D-vitamin-szintje meghaladta az ajánlott minimumot (50 nmol/L), júliustól szeptemberig tartott. A heti 18 950 NE (nemzetközi egység) D-vitamint szedő betegek szintje az UV-B sugárzástól függetlenül stabilan 70 nmol/L felett maradt, és nem mutatott évszakos ingadozást.
Mivel a D-vitamin a bőrben keletkezik az UV-B-sugárzás hatására, a kutatók nyáron mérték a legmagasabb D-vitamin szintet a betegekben. Az egyetlen időszak, amikor a vitamint nem szedő résztvevők D-vitamin-szintje meghaladta az ajánlott minimumot (50 nmol/L), júliustól szeptemberig tartott. A heti 18 950 NE (nemzetközi egység) D-vitamint szedő betegek szintje az UV-B sugárzástól függetlenül stabilan 70 nmol/L felett maradt, és nem mutatott évszakos ingadozást.
A D-vitamin szedése 50%-kal csökkentette a relapszusok számát, ez a különbség azonban szinte kizárólag a januártól márciusig tartó időszakban jelentkezett, amikor a legalacsonyabb volt a vitamin szedése nélkül mért D-vitamin-szint. Ha ezt az időszakot nem vették figyelembe, akkor a D-vitamin szedésének pozitív hatása már nem volt szignifikáns.
Egy korábbi kutatás alapján a relapszusok számának növekedése másfél hónappal az UV-B-sugárzás csökkenése után jelentkezik, ezért a D-vitamin pótlását már az őszi időszakban érdemes elkezdeni, ugyanakkor télen és kora tavasszal lehet a legfontosabb a D-vitamin-szint optimális értékének fenntartása.
Bővebben: Vitamin D supplementation differentially affects seasonal multiple sclerosis disease activity