A Magyar Neuroradiológiai Társaság XXV. kongresszusán Dr. Barsi Péter a sclerosis multiplex MRI-vel történő diagnosztizálásáról és követéséről tartott előadást, melyen szóba kerültek a kontrasztanyagok mellékhatásai is.
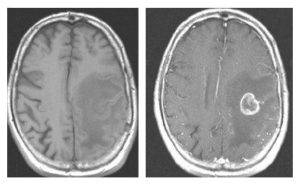
Az aktív SM léziók kimutatása − ez szükséges például az RRSM diagnózisához is − jelenleg még nem megoldható kontrasztanyagos MRI felvétel készítése nélkül. A kontrasztanyag ahhoz szükséges, hogy a felvételeken a radiológus kiemelve lássa az épp gyulladásban lévő idegrendszeri területeket. Az ehhez szükséges injekció gadolíniumot tartalmaz, ami egy mérgező szer, ezért “becsomagolva” juttatják a szervezetbe. Az MRI vizsgálat után azért ajánlják sok folyadék fogyasztását, hogy ennek kiürülése felgyorsuljon.
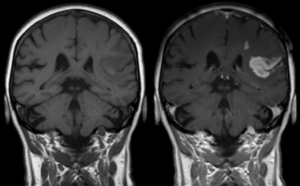
A kontrasztanyagnak sajnos mellékhatásai is lehetek. Már 2006-ban felmerült, hogy a kontrasztanyag bizonyos körülmények között lerakódik a szövetekben, és a gyengébb vesefunkciójú pácienseknél a szövetek megvastagodását − ún. nefrogén szisztémás fibrosist − okozhatja, ami ritka esetben akár halálos kimenetelű is lehet. Újabb kutatások arra utalnak, hogy gyakran végzett lineáris gadolíniumos MRI vizsgálat esetén a gadolínium az agyban is lerakódhat. A lerakódás a későbbi, kontrasztanyag nélküli MRI leleteken mutatható ki, mégpedig úgy, hogy az ilyen személyek felvételei már alaphelyzetben is kontrasztosabbak. Ez a mellékhatás jelenleg csak a kontrasztanyagos felvételek készítésének minimalizálásával csökkenthető.
A felhalmozódott gadolínium esetleges egészségkárosító hatásáról jelenleg nincsenek adatok, így több ajánlás is sürgeti ennek vizsgálatát. Amíg ez megtörténik, az EMA 2017. márciusi ajánlása alapján a lineáris gadolíniumot tartalmazó kontrasztanyagokat nem lenne szabad használni. Ez nem jelenti azt, hogy nem is használják, hiszen ez csak egy ajánlás. Ezzel szemben az amerikai irányelvek szerint továbbra is érdemes alkalmazni őket, hiszen nélkülözhetetlenek, és jelenleg semmilyen egészségre káros hatásukról nincs tudomásunk.
Amennyiben az Európai Bizottság elfogadja az ajánlást, az kötelezően betartandó lesz Európában, így Magyarországon is. Addig is érdemes lehet megfontolni a nem létfontosságú lineáris gadolíniumos MRI felvételek készítésének mellőzését.
A fent említett kontrasztanyagok esetleges kivonása nem fogja azt eredményezni, hogy onnantól kezdve nem lesz lehetőség kontrasztanyagos vizsgálatot végezni. A kontrasztanyagoknak ugyanis van egy másik típusuk, melyeknek nem lineáris, hanem makrociklikus a geometriájuk. Ezek kémiailag sokkal stabilabbak, így sokkal kisebb eséllyel engedik szabadon a gadolíniumot a szervezetben, ezáltal sokkal biztonságosabb a használatuk. Az EMA korlátozó irányelvei csak a lineáris kontrasztanyagokra vonatkoznak, és nem befolyásolják a makrociklikus változatok használatát.



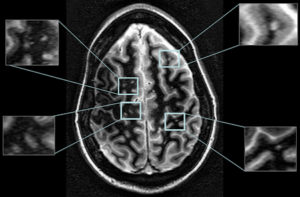 Bár a legmodernebb MRI gépek Magyarországon még nem állnak az orvosok rendelkezésére, a legtöbb esetben az itthon elérhető készülékek is elegendőek a diagnózis felállításához és az SM követéséhez.
Bár a legmodernebb MRI gépek Magyarországon még nem állnak az orvosok rendelkezésére, a legtöbb esetben az itthon elérhető készülékek is elegendőek a diagnózis felállításához és az SM követéséhez.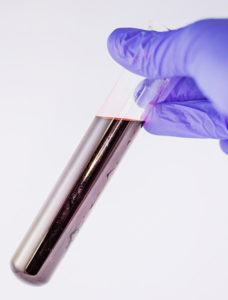 Egy 12 éven át tartó ausztrál kutatás eredményeképpen egy olyan vizsgálati eljárás született, ami a vérből 85-90%-os pontossággal meghatározza, a sclerosis multiplex mely típusával él a beteg, illetve mennyire hatékony az illető gyógykezelése.
Egy 12 éven át tartó ausztrál kutatás eredményeképpen egy olyan vizsgálati eljárás született, ami a vérből 85-90%-os pontossággal meghatározza, a sclerosis multiplex mely típusával él a beteg, illetve mennyire hatékony az illető gyógykezelése.
 A
A