Az FDA márciusban engedélyezte az első ocrelizumab hatóanyagú szer amerikai forgalmazását a sclerosis multiplex relapszáló-remittáló és elsődleges progresszív formájának kezelésére. Akkor még csak bizakodtunk, hogy az amerikainál szigorúbb európai hivatal is utat enged a gyógyszernek az Európai Unió betegei felé.
Két nappal ezelőtt azonban az EMA emberi felhasználásra szánt gyógyszereket elbíráló bizottsága (CHMP) is javasolta a gyógyszer forgalomba hozatali engedélyének megadását az EU-ban. A CHMP továbbítja ajánlását az Európai Bizottságnak, ami a gyógyszerek engedélyezéséért felel az EU-ban.
 Az Európai Bizottság rendszerint 2-3 hónappal a hivatalos ajánlást követően dönt a forgalomba hozatal engedélyezéséről. A forgalmazási engedély kiadása után a gyógyszer árazásáról az EU tagállamai már külön-külön állapodnak meg, figyelembe véve a gyógyszer potenciális szerepét az adott ország egészségügyi rendszerén belül.
Az Európai Bizottság rendszerint 2-3 hónappal a hivatalos ajánlást követően dönt a forgalomba hozatal engedélyezéséről. A forgalmazási engedély kiadása után a gyógyszer árazásáról az EU tagállamai már külön-külön állapodnak meg, figyelembe véve a gyógyszer potenciális szerepét az adott ország egészségügyi rendszerén belül.
A hatóanyag hazai színre lépésével egyfelől bővülni fog az RRSM kezelésére alkalmas betegségmódosító terápiák skálája, másfelől ez lesz az első PPSM-re is felkínálható szer. A PPSM kezelésére ugyanis jelenleg még semmilyen eszköz nincs az orvosok kezében.
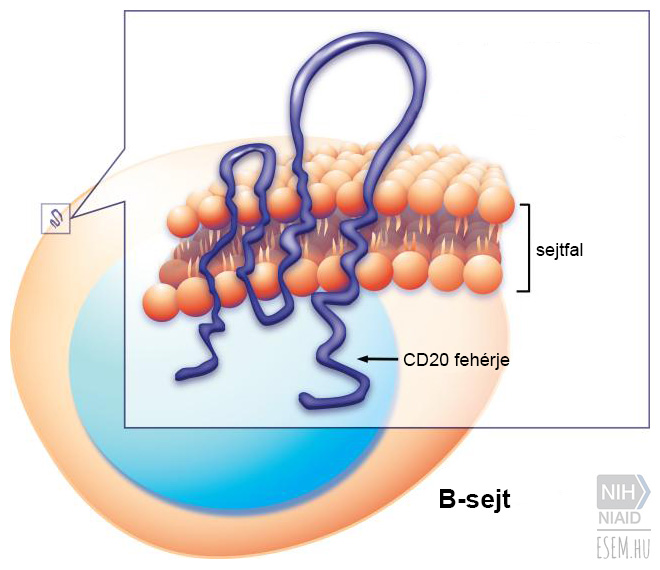
Az ocrelizumab működési mechanizmusáról és hatásosságáról itt írtunk.
Bővebben:
New medicine for multiple sclerosis