A sclerosis multiplex két leggyakoribb formája, a relapszáló-remittáló (RRSM) és a másodlagos progresszív (SPSM) szakasz közötti átmenet idejét nem tudjuk pontosan megjósolni, ám egy új megfigyelés szerint a gerincvelő szövetvesztesége megbízható előrejelzője ennek a kritikus váltásnak.
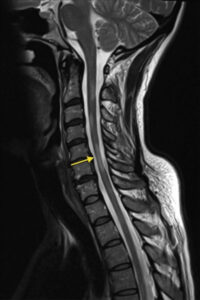
A korábbi tapasztalatok alapján az összes MRI-vel észlelhető idegrendszeri elváltozás közül a gerincvelőben találtak állnak a legerősebb összefüggésben az SM okozta rokkantsággal, valamint ezek különítik el leginkább a relapszáló-remittáló betegeket a kór progresszív formáitól, azaz az SPSM és a PPSM formájától egyaránt.
A még 2004-ben kezdődött longitudinális kutatás főszereplője az az 54 beteg volt, akik a kutatás 12 éve során RRSM-ről SPSM-re váltottak. Az ő adataikat vetették össze 54 olyan RRSM betegével, akik demográfiailag és klinikai tüneteikben is hasonlítottak hozzájuk.
A 12 év méréseinek eredménye szerint azok a betegek, akik ez idő alatt RRSM-ről SPSM-re váltottak, lényegesen gyorsabb ütemű − számszerűen átlagosan 2,25%/év −, C1 magasságban fellépő gerincvelői szövetsorvadást (azaz sejtpusztulást és az ezzel járó tömegcsökkenést) mutattak azoknál, akik RRSM fázisban maradtak (náluk ez a szám 0,74%/év volt). Márpedig ez a különbség már négy évvel azelőtt megfigyelhető, hogy az illető klinikai szinten “észrevenné” betegsége progresszívvé válását.
Ezzel szemben nem különbözött egymástól a két csoport az agy sorvadásának regionális és összesített mértékében, továbbá a fehérállomány lézióinak számában és kiterjedtségében sem. Sőt, nem különítette el az RRSM betegeket az időközben SPSM-mé vált páciensektől sem a relapszusok száma, sem a betegség időtartama, sem az újonnan kialakuló vagy a kiújuló léziók megjelenése, sem a betegségmódosító terápiák használata.
A C1 magasságú gerincvelői szakasz tömegének éves csökkenése a jelenleg ismert legmegbízhatóbb radiológiai eszköz az SM progresszívvé fajulásának kimutatásában. A nyaki gerinc szakasz évről évre megismételt, rutinszerű, T1-súlyozott MRI lelete tehát egy hiteles jelzője lehet a közelgő progressziónak, ami egy ideális világban a terápiás döntést akár olyan esetben is befolyásolhatja, amikor a páciensnek nincs egyéb tüneti oka a gyógyszerváltásra.
Bővebben: Accelerated Cord Atrophy Precedes Conversion to Secondary Progressive Disease in Relapsing Multiple Sclerosis
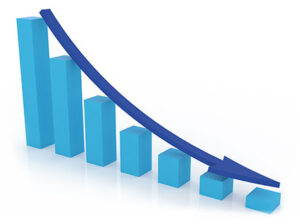 Az eredmények szerint a relapszusok száma a korral és a betegség előrehaladtával együtt csökken: a 30-40 éves SPSM betegek éves átlaga 0,11 relapszus, a 40-50 éveseké 0,06, az 50-60 éveseké 0,04 és a 60 évnél idősebbeké 0,01. A kutatók megfigyelése szerint az SPSM kórformára váltás első öt évében megjelenő relapszusok még érdemi hatással lehetnek a beteg életére, az öt év után jelentkező shubok viszont már nemigen súlyosbítják a páciens állapotát. Ezeket az adatokat érdemes lehet figyelembe venni a betegségmódosító gyógyszerek megválasztása során.
Az eredmények szerint a relapszusok száma a korral és a betegség előrehaladtával együtt csökken: a 30-40 éves SPSM betegek éves átlaga 0,11 relapszus, a 40-50 éveseké 0,06, az 50-60 éveseké 0,04 és a 60 évnél idősebbeké 0,01. A kutatók megfigyelése szerint az SPSM kórformára váltás első öt évében megjelenő relapszusok még érdemi hatással lehetnek a beteg életére, az öt év után jelentkező shubok viszont már nemigen súlyosbítják a páciens állapotát. Ezeket az adatokat érdemes lehet figyelembe venni a betegségmódosító gyógyszerek megválasztása során.


 Az emberi agy képes alkalmazkodni a változásokhoz, ideértve a különböző − öregség vagy betegségek miatti − sérüléseket is. A problémás agyterületek feladatait át tudják venni az agy környező régiói, ezáltal a beteg gyógyulást tapasztalhat annak ellenére, hogy maga a sérült terület működésképtelen marad. Az agynak ezt a képességét
Az emberi agy képes alkalmazkodni a változásokhoz, ideértve a különböző − öregség vagy betegségek miatti − sérüléseket is. A problémás agyterületek feladatait át tudják venni az agy környező régiói, ezáltal a beteg gyógyulást tapasztalhat annak ellenére, hogy maga a sérült terület működésképtelen marad. Az agynak ezt a képességét  Az 5 éves vizsgálatban olyan SM betegek vettek részt, akik már legalább 50 évesek és minimum 15 éve betegek. A kutatók arra voltak kíváncsiak, hogy milyen tulajdonságok használhatóak fel a másodlagos progresszív SM kialakulásának előrejelzésére. A vizsgálat ideje alatt a betegek 33%-a vált progresszívvé. Az ő csoportjuk tagjai négy paraméterben tértek el a relapszáló-remittáló személyektől:
Az 5 éves vizsgálatban olyan SM betegek vettek részt, akik már legalább 50 évesek és minimum 15 éve betegek. A kutatók arra voltak kíváncsiak, hogy milyen tulajdonságok használhatóak fel a másodlagos progresszív SM kialakulásának előrejelzésére. A vizsgálat ideje alatt a betegek 33%-a vált progresszívvé. Az ő csoportjuk tagjai négy paraméterben tértek el a relapszáló-remittáló személyektől:
 Ennek a 78 személynek a gondolkodásbeli képességeit úgy követték nyomon, hogy a diagnózis felállításakor és azt követően félévente végeztek velük neuropszichológiai teszteket. A kognitív folyamatokért felelős agykéreg vastagságát a kórmeghatározáskor és a vizsgálat végén kapott MRI képek összevetésével végezték. A csoportban voltak normálisan teljesítő, enyhe és súlyos kognitív hanyatlással élő páciensek egyaránt. A kutatók célja az volt, hogy a feltérképezzék a kapcsolatot a korán kialakuló kognitív deficit és az SM progressziója között.
Ennek a 78 személynek a gondolkodásbeli képességeit úgy követték nyomon, hogy a diagnózis felállításakor és azt követően félévente végeztek velük neuropszichológiai teszteket. A kognitív folyamatokért felelős agykéreg vastagságát a kórmeghatározáskor és a vizsgálat végén kapott MRI képek összevetésével végezték. A csoportban voltak normálisan teljesítő, enyhe és súlyos kognitív hanyatlással élő páciensek egyaránt. A kutatók célja az volt, hogy a feltérképezzék a kapcsolatot a korán kialakuló kognitív deficit és az SM progressziója között.