2018 októberében sokakat meglepett a hír, hogy Selma Blair amerikai színésznő nyilvánosságra hozta, hogy sclerosis multiplex-szel diagnosztizálták. Aki követte a híreket, időnként olvashatott róla, hogyan küzd a betegségével, sőt egy film is készült a küzdelmeiről, amit 2021 októberében mutattak be.
2018 októberében sokakat meglepett a hír, hogy Selma Blair amerikai színésznő nyilvánosságra hozta, hogy sclerosis multiplex-szel diagnosztizálták. Aki követte a híreket, időnként olvashatott róla, hogyan küzd a betegségével, sőt egy film is készült a küzdelmeiről, amit 2021 októberében mutattak be.
Kategória: Ismeretterjesztő cikk
Tünetleírások, életmód tanácsok, kezelési ismertetők és beszámolók közérthetően.
Szabad-e és érdemes-e sportolnod, amikor relapszusod van?
 A sclerosis multiplex és a sportolás kapcsolatát viszonylag gyakran kutatják. Több vizsgálat áttekintése alapján például úgy tűnik, hogy a rendszeres sportolás 27%-kal csökkenti az újabb relapszusok megjelenésének esélyét [1]. Arról azonban sajnos jóval kevesebb információt lehet találni, hogy relapszus idején milyen hatása van a mozgásnak, pedig a betegek számára ez kifejezetten hasznos információ lenne.
A sclerosis multiplex és a sportolás kapcsolatát viszonylag gyakran kutatják. Több vizsgálat áttekintése alapján például úgy tűnik, hogy a rendszeres sportolás 27%-kal csökkenti az újabb relapszusok megjelenésének esélyét [1]. Arról azonban sajnos jóval kevesebb információt lehet találni, hogy relapszus idején milyen hatása van a mozgásnak, pedig a betegek számára ez kifejezetten hasznos információ lenne.
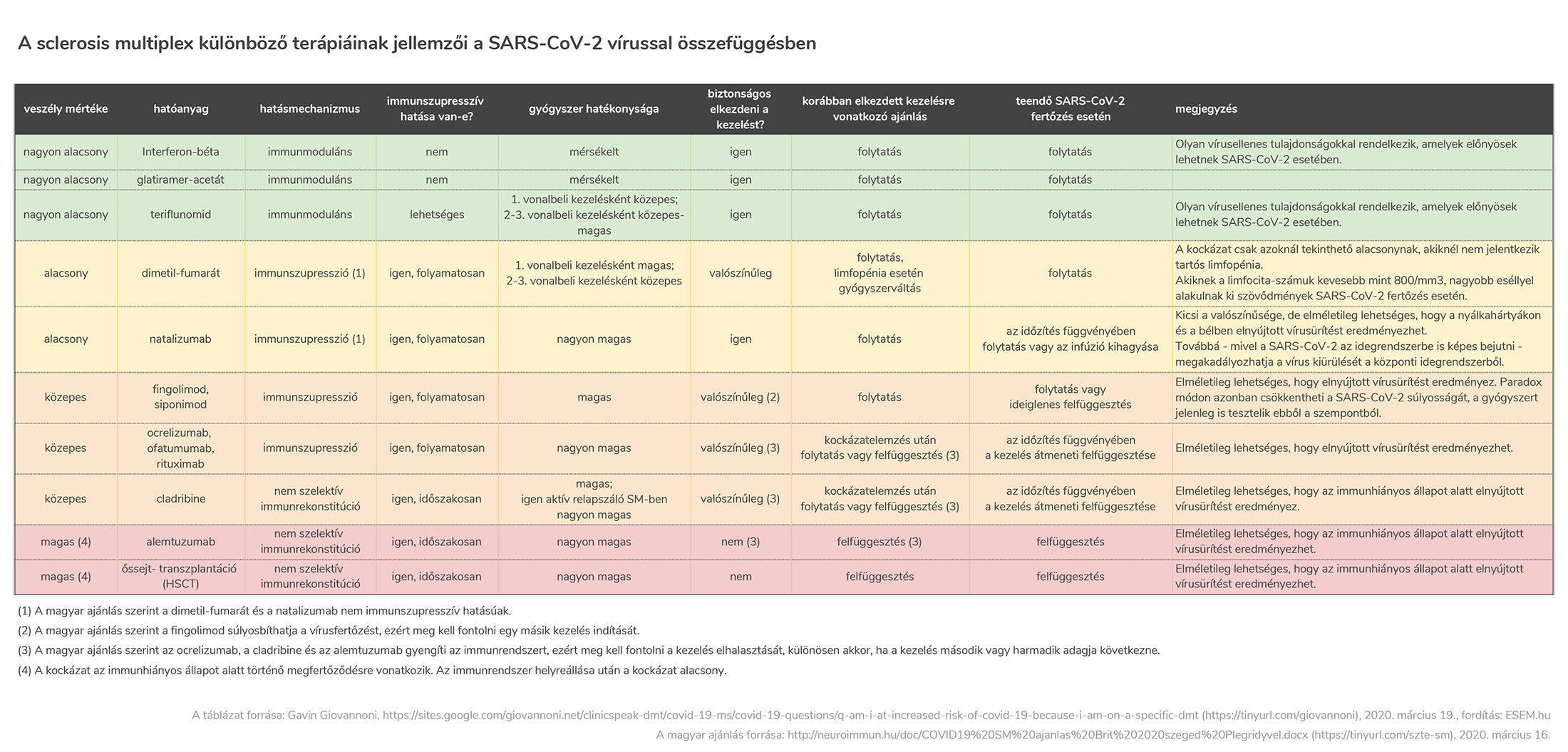
SM terápiák kockázata a koronavírussal szemben
“Hajlamosabb vagyok elkapni a koronavírust az SM terápiám miatt?” − Ez a kérdés sokakban felmerült az elmúlt hetekben. Egy londoni SM-specialista neurológus, Gavin Giovannoni erre válaszképp készített egy remek összefoglaló táblázatot arról, hogy az egyes betegségmódosító terápiák milyen kockázatot jelentenek a SARS-CoV-2 vírussal szemben. Ezt magyarítva és a Szegedi Tudományegyetem Neurológiai Klinikájának Sclerosis Multiplex Munkacsoportja ajánlásaival kiegészítve tesszük közzé:
A táblázat PDF formátumban:
esem.hu/SM-DMT_SARS-CoV-2.pdf
Források:
Gavin Giovannoni weboldala
Szegedi Tudományegyetem munkatársainak ajánlása (.doc)
Szexuális zavarok sclerosis multiplexben
olvasási idő: 6-7 perc
nehézségi szint: könnyű
 A sclerosis multiplexben fellépő szexuális zavarok sem az egészségügyi ellátás során, sem a tudományos kutatásokban nem kapnak akkora hangsúlyt, amekkorát előfordulási gyakoriságuk indokolna. Egy kanadai metaanalízis 43 darab, 1977 és 2015 között íródott publikáció eredményéből azt szűrte le, hogy az SM betegek 58%-át érinti valamilyen szexuális diszfunkció [1].
A sclerosis multiplexben fellépő szexuális zavarok sem az egészségügyi ellátás során, sem a tudományos kutatásokban nem kapnak akkora hangsúlyt, amekkorát előfordulási gyakoriságuk indokolna. Egy kanadai metaanalízis 43 darab, 1977 és 2015 között íródott publikáció eredményéből azt szűrte le, hogy az SM betegek 58%-át érinti valamilyen szexuális diszfunkció [1].
Tecfidera mellékhatásai
 A Tecfidera a dimetil-fumarát nevű hatóanyagot tartalmazó betegségmódosító gyógyszer relapszáló-remittáló sclerosis multiplex elsővonalbeli kezelésére. A 2014 óta Európában is forgalmazott készítményt alkalmazva az alábbiakban felsorolt mellékhatások jelentkezhetnek.
A Tecfidera a dimetil-fumarát nevű hatóanyagot tartalmazó betegségmódosító gyógyszer relapszáló-remittáló sclerosis multiplex elsővonalbeli kezelésére. A 2014 óta Európában is forgalmazott készítményt alkalmazva az alábbiakban felsorolt mellékhatások jelentkezhetnek.
Mi a sclerosis multiplex?
olvasási idő: 10 perc
nehézségi szint: közepes
Definíció
A sclerosis multiplex (SM) a központi idegrendszer krónikus betegsége, melynek neurológiai tüneteit az axont szigetelő myelinhüvely gyulladásos károsodása (demyelinizáció), valamint magának az axonnak, illetve az idegsejtnek a pusztulása okozza. A betegség BNO kódja G35H0, ahol a „G” az idegrendszeri érintettségre utal, azon belül pedig a központi idegrendszer demyelinizációs betegségei közé tartozik („35”), további alkategóriák nélkül („H0”).
A pilates előnyei sclerosis multiplexben
olvasási idő: 3 perc
nehézségi szint: könnyű
Mi a pilates?
A pilates egy olyan sport, amelynek gyakorlatai nagy hangsúlyt helyeznek az egyensúlyra, a koordinációra, az egyes testrészek összehangolt mozgására, valamint a gerincet stabilizáló mély törzsizomzat, úgy mint a has, a hát alsó szakasza és a csípő használatára, továbbá az erőfeszítést kilégzéssel kísérő, speciális légzéstechnikára. Rendszeres gyakorlással a pilates erősíti az izmokat és fokozza a rugalmasságot az egész testben.
A pilates számos neurológiai zavar esetében bizonyította már rehabilitáló hatását. A sclerosis multiplex okozta tünetek enyhítését is több ízben vizsgálták már az utóbbi 5-6 évben, ám most egy metaanalízis összesítette ennek a 28 tanulmánynak az eredményeit.
Tovább olvasomA sclerosis multiplex kognitív tünetei
olvasási idő: 5 perc
nehézségi szint: nehéz
A kognitív tünetek előfordulási arányát még napjaink klinikai gyakorlata is alábecsüli. Ennek egyik oka, hogy a mentális deficiteket nehéz egy-egy rövid rutinlátogatás alkalmával, célzott és időigényes neuropszichológiai eljárások nélkül felmérni. A másik magyarázat, hogy a közhiedelemben tévesen még mindig úgy él, a kognitív tünetek ritkák és inkább a kór késői szakaszára jellemzőek [1].
A sclerosis multiplexben megjelenő kognitív tünetek felismerésének története
olvasási idő: 3 perc
nehézségi szint: könnyű
A sclerosis multiplex kognitív tüneteinek felismeréséig hosszú út vezetett. Kezdődjék hát egy kis történelem! [1]
A betegséget a francia neurológus Jean-Martin Charcot írta le elsőként 1868-ban. [2] Ekkor még alig kaptak említést a kognitív és affektív funkciók, az akkori beszámolók elsősorban a leglátványosabb motoros és szenzoros tünetekre fókuszáltak.
A sclerosis multiplex lefolyásának előrejelzése
olvasási idő: 8-10 perc
nehézségi szint: közepes
Az MSSS (Multiple Sclerosis Severity Score) egy olyan módszer, amivel sclerosis multiplex betegek állapotának súlyosságát lehet felmérni a kór első tünete óta eltelt idő függvényében. Ezzel a számítási módszerrel összehasonlítható egy személy rokkantsági foka betegtársaihoz képest, sőt előrejelzések is tehetőek arra, hogy néhány évtizeden belül milyen állapotra számíthat.