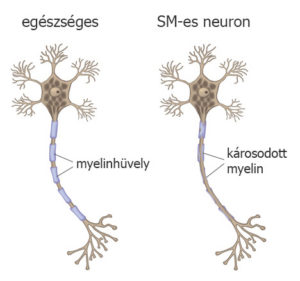
A myelinhüvely jelentősége
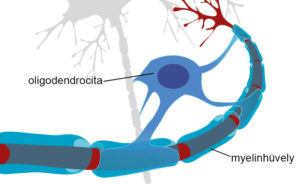
A központi idegrendszer sejtjei közötti kapcsolatot azok nyúlványai, az axonok teremtik meg egymással. Az axonokat egy védőburok, a myelinhüvely veszi körül. A védőburkon belül az idegsejtek nyúlványai ideális környezetben vannak, és teljes hatékonysággal tudják szállítani az információt. Sclerosis multiplexben egy relapszus során ez a myelin károsodik. Ha a myelin nem épül vissza, akkor a relapszus során megjelenő tünetek megmaradnak, állandósulnak, hiszen az idegsejtek közötti információáramlás akadozik vagy akár teljesen megszűnik.
A myelint az oligodendrocita sejtek hozzák létre az agyban és a gerincvelőben. Ha azonban ezek a sejtek valamiért nem termelnek myelint, akkor esélytelen a felépülés az adott relapszusból.
Az oligodendrociták felelőssége
Korábbról már ismert volt, hogy az SM betegek agyában felhalmozódik a hialuronsav, és ez összefügg az oligodendrocita sejtek elégtelen működésével. A kettő úgy függ össze egymással, hogy az SM-ben megjelenő léziókban a hialuronsavat a hialuronidáz enzimek bontják le, és ezek egy olyan jelet küldenek az oligodendrocitákhoz, aminek hatására azok nem kapcsolják be a myelintermelésért felelős génjeiket.
A hialuronidáz enzimek féken tartása
A fentiek alapján egy nemzetközi kutatócsoport azt kezdte el vizsgálni, hogy a hialuronidáz enzimek gátlásával hogyan lehetne a myelin újratermelését elősegíteni. Már tíz éve dolgoznak egy olyan molekula kifejlesztésén, ami semlegesíti a hialuronidáz enzimeket, és ezáltal újra aktiválja az oligodendrociták működését.
 Az S3-nak elnevezett molekula éppen ezt teszi. Egérkísérletekben már bizonyította, hogy fokozza a myelin újratermelését. Sőt, az S3 nemcsak helyreállította a myelinhüvelyt, hanem az idegsejtek közötti kommunikációt is felgyorsította, azaz valóban olyan jól funkcionáló myelin jött létre a hatására, amilyennel az ép idegrendszer működik. Ez azért jelentős eredmény, mert ezek szerint az S3 ténylegesen a célnak megfelelő működésre késztette az oligodendrocita sejteket.
Az S3-nak elnevezett molekula éppen ezt teszi. Egérkísérletekben már bizonyította, hogy fokozza a myelin újratermelését. Sőt, az S3 nemcsak helyreállította a myelinhüvelyt, hanem az idegsejtek közötti kommunikációt is felgyorsította, azaz valóban olyan jól funkcionáló myelin jött létre a hatására, amilyennel az ép idegrendszer működik. Ez azért jelentős eredmény, mert ezek szerint az S3 ténylegesen a célnak megfelelő működésre késztette az oligodendrocita sejteket.
Az S3 molekula további útja
A sikeres egérkísérletek után a kutatók már megkezdték a molekula tesztelését japán makákó encephalitis-szel fertőzött majmokon. Ha ez is eredményesen zárul, körülbelül egy év múlva megkezdődhetnek az embereken végzett vizsgálatok is.
Bővebben:
Egy új hatóanyag elősegítheti a mielinhüvely gyógyulását idegrendszeri betegségekben → Pharmindex
New compound promotes healing of myelin in nervous system disorders → Medical Xpress
A modified flavonoid accelerates oligodendrocyte maturation and functional remyelination → Glia

 Hosszú út vezetett, mire kiderült, hogy a testedzés nem csak hogy nem káros a sclerosis multiplex betegekre nézve, hanem egyszerre segít mérsékelni a páciensek tüneteit és javítani az általános egészségi állapotukat. Így bár régebben kifejezetten óvták a betegeket a testedzéstől, mára már kulcsfontosságú szerepet kaptak az ellenállásos edzésformák (pl. súlyemelés) és az aerob sportok (pl. futás, úszás) az SM-mel történő harcban. Egy friss kanadai kutatás molekuláris szinten is igazolta, hogy a futás késlelteti a
Hosszú út vezetett, mire kiderült, hogy a testedzés nem csak hogy nem káros a sclerosis multiplex betegekre nézve, hanem egyszerre segít mérsékelni a páciensek tüneteit és javítani az általános egészségi állapotukat. Így bár régebben kifejezetten óvták a betegeket a testedzéstől, mára már kulcsfontosságú szerepet kaptak az ellenállásos edzésformák (pl. súlyemelés) és az aerob sportok (pl. futás, úszás) az SM-mel történő harcban. Egy friss kanadai kutatás molekuláris szinten is igazolta, hogy a futás késlelteti a