A klinikai kutatás szakaszai
olvasási idő: 9 perc
A gyógyszeriparban dolgozó kutatók azon dolgoznak, hogy a jelenleg használatban lévő gyógyszerek további fejlesztéseknek köszönhetően még nagyobb hatékonysággal működjenek, illetve hogy az egyelőre gyógyíthatatlan betegségekre megtalálják a gyógymódot. Egy új molekula vagy hatóanyag összeállítása után éveken át tartó kísérletsorozat következik. Ennek célja az új anyag gyógyító erejének és esetleges nem kívánt hatásának feltérképezése. A gyógyszerek klinikai vizsgálatával garantálható, hogy az új anyag csak akkor kerül a betegek kezébe, ha az biztonságos és valóban hatékony a páciens betegségére.
A klinikai kutatás szakaszairól íme egy ízelítő táblázat:
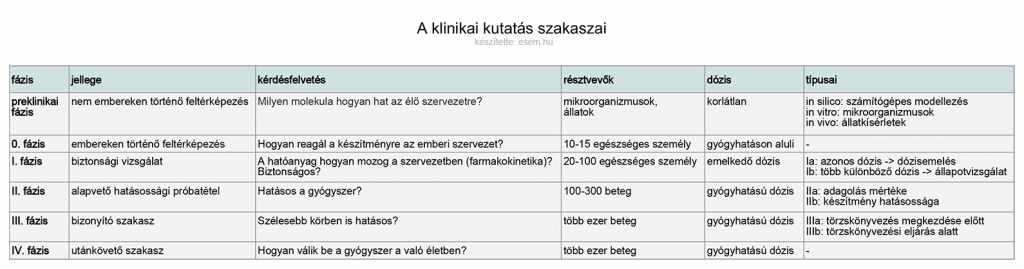
Preklinikai szakasz
Bármiféle tényleges vizsgálat előtt a kutatók számítógépes modellezéssel (in silico) térképezik fel, milyen molekula hogyan hathat az élő szervezetre. Miután a kutatók egy új molekulát vagy vegyületet megalkotnak, azt elsőként elkülönített sejt- és szövettenyészeteken, mikroorganizmusokon (in vitro) majd ezt követően állatokon végzett kísérletekkel (in vivo) tesztelik, hogy előzetes képet kapjanak az anyag működéséről. A szert sok különböző dózisban juttatják az organizmusokba, hogy felmérjék a hatóanyag eredményességét és esetleges mérgező hatását a különböző szervrendszerekre.
A gyógyszercég ennek a fázisnak a végén dönti el, hogy az újonnan kifejlesztett hatóanyag érdemes-e a további vizsgálatra, elképzelhető-e, hogy végül egy valódi új gyógyszer lesz belőle. Ezek a megfigyelések évekig tartanak, és nagyságrendileg a kifejlesztett hatóanyagoknak csak 0,1%-a (azaz ezer próbálkozásból egyetlen egy) érdemes arra, hogy a kutatók tovább foglalkozzanak vele.
Klinikai vizsgálat 0. fázisa
Ebben a szakaszban már emberek a kísérleti alanyok. Ők igen kis dózist kapnak a gyógyszerből, éppen csak annyit, amennyi ahhoz elég, hogy a kutatók meggyőződjenek arról, a szer valóban úgy működik, ahogyan a preklinikai szakasz eredményei alapján elvárják. Körülbelül 10-15 önkéntesen vállalkozó egészséges ember adata elég is ahhoz, hogy előzetesen felmérjék, hogyan reagál az emberi szervezet a készítményre. Itt még nem vizsgálják, van-e a készítménynek bármi terápiás hatása, hiszen a kísérleti alanyok nem is kapják a szert olyan dózisban, amellyel ez tesztelhető lenne. Éppen emiatt sokan úgy gondolják, ez a fázis felesleges időhúzás, és gyakran ki is hagyják ezt a lépcsőfokot, így egyből a következőre lépnek.
I. fázis
Ebben a fázisban már olyan dózisú szert kapnak a kísérleti személyek, amelynek már valódi hatása lehet a szervezetre. Itt ugyanis az a cél, hogy leírják a hatóanyag farmakokinetikáját, azaz azt, hogy az anyag hogyan mozog a szervezetben: hogyan oszlik el a testen belül, milyen a felszívódása és mennyi idő alatt ürül ki a szervezetből. Egyúttal már itt elkezdik az esetleges mellékhatások számbavételét is.
A kísérleti alanyok itt is egészséges önkéntesek (nagyságrendileg 20-100 fő), általában fiatalok, akik anyagi díjazás ellenében vállalják a részvételt. A honorárium jellemzően pár százezer forint, de nagyban függ a kísérletben történő részvétel idejétől. Ha olyan hatóanyagot vizsgálnak, ami egészséges emberekre káros hatással lehet, a kísérleti személyek olyan betegek, akik nagy valószínűséggel jól reagálnak majd a gyógyszerre. Ez elsősorban az előrehaladott rák és a HIV ellen kifejlesztett készítményekre igaz.
Az I. fázisú vizsgálatnak két típusa van. Mindkettőnek az a lényege, hogy a kísérleti személyek egyre emelkedő dózisban kapják a szert, hogy megállapítsák az elviselhető és az optimális dózis mennyiségét. Mindeközben az alanyok folyamatos, szoros orvosi kontroll alatt állnak.
Ia fázis
Az emberek egy kis csoportja (általában 3 fő) mindig ugyanakkora dózist kap a szerből. Ha ők nem tapasztalnak semmilyen kedvezőtlen mellékhatást, és a farmakokinetikai adatok nagyjából megfelelnek az előzetes elvárásoknak, egy másik csoport egy picivel nagyobb dózist kap, és így tovább. Amennyiben akár csak egy ember is zavaró mellékhatást tapasztal, ugyanezt a dózist újabb 3 főn tesztelik. Ez a lépegetés folytatódik addig, amíg el nem jutnak a maximálisan adható dózisig, ami az a mennyiség, amire az emberek egyharmada zavaró mellékhatásokkal reagál.
Ib fázis
Az egyes emberek több különböző dózisban kapják a gyógyszert (de elsőként természetesen igen csekély mennyiségben). Közben véletlenszerű időközönként megvizsgálják őket annak érdekében, hogy nyomon kövessék a szer feldolgozását. A dózis emelését mindig új csoport tagjain végzik, egészen addig, amíg egy előre meghatározott szintig el nem jutnak.
II. fázis
Itt már olyan betegeken elemzik a gyógyszer hatásosságát, akik abban a kórban szenvednek, amelynek kezelésére a szert kifejlesztették. A pácienseket nemük, koruk, állapotuk, kísérőbetegségeik, vérképük és egyéb orvosi adataik figyelembevételével választják ki [1]. A bevont betegek száma 100-300 között mozog. Ekkor derül ki, hogy a tényleges betegségre hatással van-e a készítmény, és ha igen, mi annak optimális dózisa. Ezen kívül a célcsoport tagjain tovább vizsgálják a készítmény biztonságosságát, mellékhatásait és egyéb kockázatait. Ezt vagy esettanulmányszerűen végzik, páciensek egy csoportján bemutatva a szer hatásosságát, vagy randomizált, kontrollált kísérlet formájában, amikor a betegek egyik csoportja az új gyógyszert, egy másik csoportja pedig placebót (azaz hatóanyag nélküli készítményt) kap, és az új szer hatását a két csoport eredményei közti különbségek adják. (Ez utóbbi módszerről részletesebben itt írtunk: Honnan tudjuk, hogy gyógyít-e valami?)
A II. fázisú feltáró (exploratory) vizsgálat néha két külön szakaszra oszlik. Elsőként, a IIa fázis során meghatározzák az adagolás mértékét, tehát hogy mekkora dózisban kapják a páciensek a gyógyszert. Ezután, a IIb fázis alatt tanulmányozzák a készítmény hatásosságát, azaz hogy az előzőleg meghatározott dózisban mennyire jól működik a gyógyszer. Egy új készítménynél ez a legszigorúbb választóvonal a hatásosság kérdésében, ezért gyakran hivatkoznak erre a fázisra “alapvető próbatételként” (pivotal trial).
Ha a gyógyszer ebben a fázisban hatásosnak bizonyul és a mellékhatások is még az elfogadható kereten belül vannak, a készítmény tanulmányozása továbbléphet a következő szakaszba. Azonban ebben a fázisban vérzik el a legtöbb új tervezésű gyógyszer, jellemzően amiatt, hogy kiderül, a hatóanyag nem úgy működik, ahogyan feltételezték. Egy 2008-as adat szerint a II. kísérleti szakaszig eljutó készítményeknek mindössze 18%-a mehet tovább a III. fázisba [2].
III. fázis
Ennek a bizonyító (confirmatory) fázisnak a célja a kísérlet korábbi szakaszaiban nyert eredmények megerősítése egy nagyobb és színesebb betegpopuláción. Itt már több ezer önként vállalkozó betegen, világszerte több helyszínen (szaknyelven multicentrikus formában) vizsgálják a gyógyszer biztonságos alkalmazhatóságát, terápiás hatásosságát és mellékhatásait. Egyúttal össze is hasonlítják az új készítményt a már bevált, aktuálisan alkalmazott terápiák hatásfokával, valamint meghatározzák a gyógyszer adagolásának általános protokollját. Mivel ez a kísérletsorozat tart a leghosszabb ideig és ez kívánja meg a legtöbb kutató és páciens közreműködését, ez a legköltségesebb vizsgálati szakasz.
Ha a készítmény itt sikerrel teljesít, megindulhat a nemzetközi törzskönyvezési eljárás a hivatalos szervek felé, amit Amerikában az FDA (Food and Drug Administration), Európában az EMA (European Medicines Agency) végez. A törvényesítés után az újonnan kifejlesztett hatóanyagot gyógyszernek ismerik el, és engedélyezik rutinszerű alkalmazását. Egy 2010-es adat szerint a III. szakaszba eljutó gyógyszerek felének ér véget a pályafutása ebben a fázisban a széleskörű kísérletek negatív eredményei miatt vagy a hatóságok visszautasítása által [3].
Elterjedt gyakorlat, hogy egyes vizsgálatok még akkor is zajlanak, amikor a törzskönyvezési eljárás már folyamatban van. Ez egyfelől jó a kísérletben résztvevő betegeknek, mert addig is ingyenesen hozzájuthatnak a gyógyszerhez. Másfelől a gyógyszercégnek is előnyére válik, mert több adathoz juthatnak, új kutatási irányokat szerezhetnek (pl. életminőségre vonatkozó vizsgálatok), sőt akár olyan eredményeket is kaphatnak, amelyek üzleti előnyökkel járnak. Ha ugyanis kiderül, hogy a készítmény az eredetileg megcélzott betegség mellett más kórok vagy tünetek kezelésére is alkalmas, azzal kibővíthetik a betegtájékoztatóban szereplő ajánlásokat. Ezeket a “háttérben futó” vizsgálatokat IIIb fázis alatti próbáknak nevezik.
IV. fázis
Biztonsági okokból a gyógyszert a hivatalos bevezetést követően még legalább két éven át figyelni kell. Ennek során a gyógyszert összehasonlítják a konkurens termékekkel, hosszú távon vizsgálják a terápiás hatását, regisztrálják a ritkábban fellépő és hosszú távú mellékhatásokat, elemzik az egyéb gyógyszerekkel történő kölcsönhatásokat, tesztelik a készítményt a várandósság alatti szedhetőség szempontjából, valamint személyre szabhatóan pontosítják az adagolást. Ebben a kísérleti szakaszban általában több ezer nagyon különböző életkorú, származású és betegségmúltú páciens vesz részt, akik egyébként is kezelésre szorulnak, és minden eddiginél hosszabb idő áll rendelkezésre ahhoz, hogy bebizonyosodjon egy új készítmény biztonságos használata. Ezt a fázist bevezetés utáni utánkövető szakasznak (observational surveillance) is hívják. Ha a két év során bárhonnan bármilyen nem elhanyagolható káros hatást tapasztalnak a páciensek, korlátozzák a gyógyszer használatát vagy azonnal visszahívják a piacról a terméket.
Az egész procedúra a kutatói laborban történő kifejlesztéstől a IV. fázis végéig körülbelül 12-18 éven át tart, és nagyságrendileg 250 milliárd forintba kerül [4]. Ezt az óriási kutatási költséget fizettetik meg a gyógyszercégek a későbbi betegekkel, belekalkulálva a megtérülést termékük piaci árába. Ezen kívül nem árt, ha még valami profitot is teremtenek, hogy a jövőben is hasonlóan eredményes termékeket fejlesszenek.
A cikkhez felhasznált online anyagok
Phases of clinical research
Phases of clinical trials (PDF)
Biomedicinális kutatás konferencia előadása, 2010. (PPT)